Výzkum
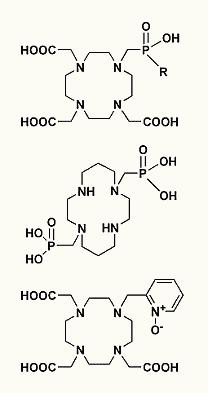
Hlavním tématem našeho výzkumu je koordinační chemie iontů přechodných kovů a lanthanoidů ve vodném prostředí, syntéza a studium nových ligandů a jejich komplexů vhodných pro biomedicínské aplikace. V klinické medicíně je denně používáno mnoho látek založených na sloučeninách přechodných kovů. Přechodné kovy se však ukládají v tkáních a vykazují značnou toxicitu, což vylučuje jejich aplikaci ve formě jednoduchých solí. Aby toxický ion kovu mohl být použit v klinické praxi, musí být vázán v dostatečně termodynamicky a kineticky stabilním komplexu. Termodynamická stabilita zajišťuje jeho stálost v přítomnosti konkurujících biogenních ligandů nebo kovových iontů za rovnovážných podmínek. Kinetická inertnost dále snižuje pravděpodobnost rozpadu komplexu. Základní výzkum v této oblasti anorganické chemie je tedy zaměřen na hledání ligandů, které budou s kovy vytvářet komplexy dostatečně stabilní in vivo. Tyto komplexy musí samozřejmě v organismu plnit taktéž očekávanou léčebnou nebo diagnostickou funkci.
Nejvýznamnější aplikací těchto látek je radiomedicína (radiodiagnostika a radioterapie) a magnetická rezonance (tomografie MRI) a další zobrazovací metody souhrně označované jako „Molecular Imaging“.
Molecular Imaging
Molecular Imaging je souhrný název pro řadu zobrazovacích metod používaných v medicíně a molekulární biologii (v medicíně často označovaných jako CT – Computer Tomography), které využívají pro lepší efekt tzv. kontrastních látek. Jedná se hlavně o tomografii MRI (Magnetic Resonance Imaging), radiodiagnostické metody (SPECT – Single Photon Emission Computer Tomography, PET – Positron Emission Tomography), optické zobrazovací metody (luminiscenční a fluorescenční značení) a ultrazvuk.
Magnetická rezonance
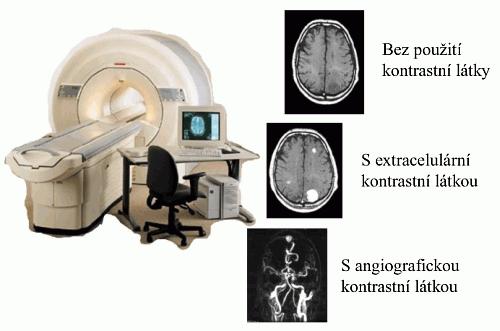
Tomografie magnetické resonance (MRI – magnetic resonance imaging) sleduje chování molekul vody, pokud jsou vystaveny vnějšímu magnetickému poli tomografu. Toto chování se mění dle množství vody v jednotlivých tkáních, koncentrace různých složek tělních tekutin, pH a teploty. Zásadním způsobem ovlivňuje chování molekul vody přítomnost paramagnetických látek. Proto jsou používáné kontrastní látky založeny na gadolinitém iontu. Tento ion je, stejně jako ionty jiných přechodných kovů a lanthanoidů, značně toxický. Jeho komplexace vhodným ligandem za vzniku komplexu však značně snižuje jeho schopnosti měnit kontrast tělních tkání. Vhodné komplexy musí být dostatečně stabilní, ale musí současně umožňovat přenos magnetické informace mezi kovovým iontem a okolním roztokem. Designem vhodných ligandů se intensivně zabývá řada světových pracovišť. Jednou z cest ke zlepšení vlastností kontrastních látek pro MRI je vázání na makromolekulární nosič. Další skupina látek studovaných z hlediska aplikace v MRI je založen na superparamagnetických vlastnostech nanokrystalického oxidu železitého. Současně se intenzivně pracuje na přípravě obou typů kontrastních látek selektivně se vážících na určitý typ tělní tkáně (tzv. „targetingu“), což umožňuje snížení aplikované dávky kontrastní látky za současného zvýšení kontrastu.
Kontrastní látky pro tomografii magnetické rezonance
Kontrastní látky pro MRI používané v dnešní době v klinické praxi jsou založeny na gadolinitém iontu.
Vzhledem k toxicitě tohotu iontu a relativně vysokým aplikovaným dávkám (1 až 10 g
na jedno vyšetření) musí být vázán v termodynamicky i kineticky stabilním komplexu.
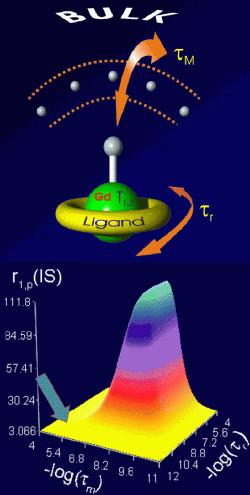
Účinnost takového komplexu jako kontrastní látky pro MRI se vyjadřuje jako relaxivita
(rychlost relaxace protonů molekul vody v roztoku zkoumané kontrastní látky o koncentraci
1 mM). Relaxivita komplexu je závislá na mnoha parametrech, mezi něž patří síla magnetického pole
tomografu MRI, teplota, počet molekul vody koordinovaných ke gadolinitému iontu, rychlost výměny
koordinované molekuly vody τM, rotační korelační čas τr, elektronické
parametry Gd3+ iontu atd. Při charakterizaci komplexů lanthanoidů se využívá převážně NMR,
EPR a luminiscenční spektroskopie.
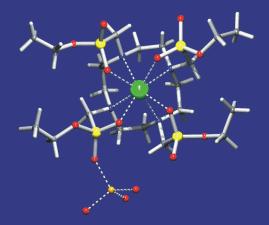
Koordinační číslo Gd3+ iontu je 8 nebo 9 v závislosti na objemnosti ligandů.
Pro tomografii MRI se využívají převážně chelatující ligandy koordinující s osmi donorovými
atomy, které nejsou příliš stéricky náročné (všechny dnes klinicky používané kontrastní látky jsou
deriváty polyaminokarboxylátů
DOTA
a DTPA),
aby deváté koordinační místo mohlo být obsazeno molekulou vody. Výměna této molekuly vody za jinou
molekuly vody z roztoku je hlavním prostředkem přenosu magnetické informace z komplexu na okolní prostředí.
Pokud by ke gadolinitému iontu nebyla koordinována žádná molekula vody, byl by tento přenos silně omezen
a došlo by k zásadnímu snížení účinnosti kontrastní látky. Pokud by naopak byly
koordinovány dvě či více molekul vody, dochází ke snížení stability takového komplexu; navíc
flexibilita koordinačního okolí pak umožňuje po aplikaci nahrazení koordinovaných molekul vody
biogenními ligandy (acetát, karbonát, aminokyseliny atd.), což se opět projeví značným poklesem
účinnosti kontrastní látky. Rychlost výměny molekuly vody mezi koordinační sférou kovu a okolním
roztokem je jedním z důležitých parametrů, které lze ovlivnit chemickou cestou – výběrem vhodných
ligandů. Pro maximální účinnost by střední doba setrvání molekuly vody v první koordinační sféře
(tzv. rezidenční čas τM) měla odpovídat
Radiomedicínské aplikace
Radiomedicína je dnes využívána hlavně při diagnostice a terapii nádorových onemocnění.
Jedním z nejčastěji užívaných radioizotopů je 99mTc, jehož měkké
Studium stability komplexů
Komplexy přechodných kovů a lanthanoidů pro biomedicínské aplikace musí vykazovat vysokou kinetickou
i termodynamickou stabilitu, aby nedocházelo k jejich rozpadu a intoxikaci organismu kovovými ionty.
Izotopy používané v radiomedicíně mají obvykle poločas rozpadu v řádu desítek minut až desítek hodin.
Proto je nutno co nejvíce zkrátit celý proces přípravy komplexů a rychlost komplexace se stává důležitým
parametrem. Nová generace radiofarmak pak často obsahuje složky citlivé na teplotu a pH (peptidy,
polysacharidy), což vytváří další omezení pro komplexaci kovových iontů těmito ligandy. Kinetické
studium vzniku a rozkladu komplexů je obvykle prováděno metodou UV/vis spektroskopie a zahrnuje nejen
stanovení rychlosti reakcí, ale též stanovení reakčních mechanismů. Jelikož vznik komplexů polydentátních
ligandů vykazuje často poměrně složitý mechanismus, je jeho pochopení klíčové při navrhování ligandů nových,
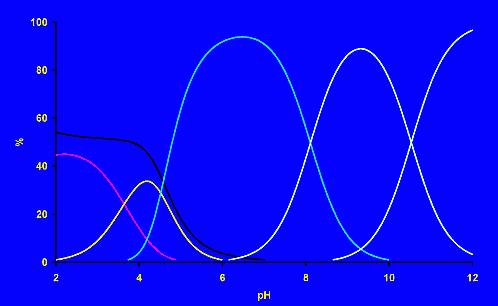
které lépe splňují daná kriteria. Termodynamická stabilita komplexů a úzce související acidobazické
vlastnosti ligandů jsou většinou stanovovány pomocí potenciometrických titrací. Změny v roztocích lze
 sledovat prostřednictvím řady metod. Mezi nejrozšířenější patří právě pH metrie (změna koncentrace
H+ iontů uvolňujících se při vzniku komplexu), NMR spektroskopie (změna chemického posunu některého
z NMR aktivních jader jako důsledek změny geometrie a elektronických poměrů při vzniku komplexu)
či UV/vis spektroskopie (barevné změny v roztoku jako důsledek změny koordinačního okolí kovových
iontů nebo stavu ligandů po koordinaci). Těmito metodami lze zjistit nejen termodynamickou stabilitu
komplexů, ale i identifikovat složení komplexů přítomných v roztoku (různé poměry kov–ligand, různé
stupně protonizace). Výše zmíněné metody poskytují jen omezenou informaci o skutečné struktuře
studovaných komplexů. Mezi metody, které umožňují takové informace získat, patří především spektroskopické
metody (NMR, EPR, absorpční a luminiscenční spektroskopie) a RTG difrakční analýza.
sledovat prostřednictvím řady metod. Mezi nejrozšířenější patří právě pH metrie (změna koncentrace
H+ iontů uvolňujících se při vzniku komplexu), NMR spektroskopie (změna chemického posunu některého
z NMR aktivních jader jako důsledek změny geometrie a elektronických poměrů při vzniku komplexu)
či UV/vis spektroskopie (barevné změny v roztoku jako důsledek změny koordinačního okolí kovových
iontů nebo stavu ligandů po koordinaci). Těmito metodami lze zjistit nejen termodynamickou stabilitu
komplexů, ale i identifikovat složení komplexů přítomných v roztoku (různé poměry kov–ligand, různé
stupně protonizace). Výše zmíněné metody poskytují jen omezenou informaci o skutečné struktuře
studovaných komplexů. Mezi metody, které umožňují takové informace získat, patří především spektroskopické
metody (NMR, EPR, absorpční a luminiscenční spektroskopie) a RTG difrakční analýza.
Targeting
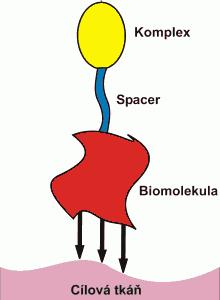
Targeting (specifická vazba na cílovou tkáň) je metodou umožňující výrazné snížení aplikovaných dávek farmaka (kontrastní látka, účinná látka atd.) za současného udržení či dokonce zvýšení jeho efektu. Tohoto lze dosáhnout, pokud je k danému léčivu připojena vhodná biologicky aktivní molekula, která vykazuje zvýšenou afinitu vůči určité tělní tkáni. Po aplikaci takové látky dojde k jejímu navázání na cílovou tkáň, kde plní požadovanou funkci. Takovou biologicky aktivní molekulou mohou být jednoduché peptidy (např. modifikované hormony, jako jsou analoga somatostatinu), polysacharidy, monoklonální protilátky, látky vážící se prostřednictvím hydrofobních interakcí,
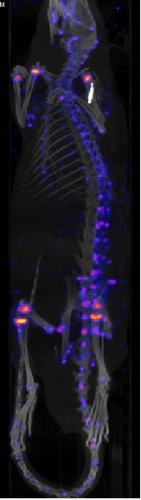
PET (Positron Emission Tomography) zobrazení myši, které byla podána kontrastní
látka selektivně se vážící na kostní tkáň připravená v naší skupině komplex
Aktuálně
Hledáme nové postgraduální studenty
2. 6. 2020
Prohlédněte si vypsaná témata dizertačních prací a napište nám o další informace (kubicek@natur.cuni.cz).


