| FLUIDNÍ INKLUZE - úvodní stránka | ||
| Předchozí stránka | Obsah textu | Následující stránka |
| 7.3. Binární H2O - CO2 a vícesložkový H2O – CO2 - NaCl (± CH4 - N2) systém |
| FLUIDNÍ INKLUZE - úvodní stránka | ||
| Předchozí stránka | Obsah textu | Následující stránka |
| 7.3. Binární H2O - CO2 a vícesložkový H2O – CO2 - NaCl (± CH4 - N2) systém |
Fázové vztahy v těchto systémech jsou výrazně složitější ve srovnání se systémy obsahujícími jen H2O (± soli) či jen CO2 (± plyny). Příčinou je výrazný rozdíl v charakteru molekul (CO2: velká, nepolární molekula; H2O: malá, dipolární molekula) a velké PT rozdíly v kritických a trojných bodech H2O a CO2.
Systém H2O - CO2 zahrnuje celkem šest fází (led, pevný CO2, klatrát-CO2, páru, kapalinu bohatou H2O (LAQ), kapalinu bohatou CO2 (LCAR)). Klatrát je pevná hydratovaná fáze CO2 o přibližném složení CO2 ž 7.5 H2O. Systém obsahuje tři čtverné body (invariantní body, kde koexistují čtyři fáze) značené obvykle Q1 až Q3 (Tab. 7) a dva kritické body nad nimiž (ve smyslu PT podmínek) existují pouze nadkritická fluida/tekutiny (dolní a horní kritický bod; lower critical end-point /LCEP/ and upper critical end-point /UCEP/).
Tab. 7. PT podmínky významných bodů v systému H2O - CO2
| PT podmínky: | koexistující fáze: | |
| Q1 | -1.5 °C; 10.3 bar | pára + klatrát + LAQ + led |
| Q2 | +10.0 °C; 45.1 bar | pára + klatrát + LAQ + LCAR |
| Q3 | -56.6 °C, 5.2 bar | pevný CO2 + pára + klatrát + LCAR |
| LCEP | +31.05 °C; 73.9 bar | LAQ + LCAR + pára « SCFCAR + LAQ |
| UCEP | přesné PT podmínky nejsou známy, p > 50 kbar | LAQ + LCAR + klatrát (?) « SCF |
| Poznámky: SCFCAR = nadkritická CO2 tekutina (angl. fluid) SCF = nadkritická H2O - CO2 tekutina (angl. fluid) | ||
Při mikrotermometrickém studiu H2O - CO2 inkluzí lze měřit teploty následujících fázových změn: tání pevného CO2 (Tm-CO2), tání ledu (Tm-ice), tání klatrátu CO2 (Tm-CLA), homogenizaci CO2 fáze (Th-CO2, někdy označovaná jako parciální homogenizace) a teplotu celkové (konečné) homogenizace (Th-tot) nad níž existuje již jen nadkritická tekutina.
PT podmínky tří z těchto pěti fázových změn jsou v čistém H2O - CO2 sytému pevně určeny čtvernými body (tzn.: Tm-CO2 = Q3; Tm-CLA = Q2; Tm-ice = Q1; viz. výše). Pokud jsou však ve vodě rozpuštěny nějaké elektrolyty (např. NaCl), či v CO2 je přítomna příměs dalších plynů (např. CH4, N2), pak uvedené vztahy již neplatí (tzn.: Tm-CO2 ¹ Q3; Tm-CLA ¹ Q2; Tm-ice ¹ Q1). Příměs jakéhokoli dalšího plynu snižuje teplotu tání pevného CO2 (Tm-CO2) - viz. kap. 7.2.3. V případě CH4, N2, H2 a CO se snižuje i maximální možná teplota homogenizace CO2 fáze (Th-CO2), ve zbývajících (v praxi velmi vzácných) případech (H2S, SO2, NH3) se Th-CO2 může i zvýšit.
Teplota tání ledu (Tm-ice), podle které se ve vodných systémech určuje salinita, se u smíšených systémů H2O - CO2 - soli neměří a k určování salinity nepoužívá. Důvodem je vazba části H2O během vymrazování/tání inkluze do struktury klatrátu (CO2 ž 7.5 H2O). Zbývající voda v inkluzi je proto relativně obohacena o rozpuštěné sole (nevstupují do klatrátu). Salinita určená podle tání ledu v těchto případech by byla proto vyšší než skutečná a tudíž i chybná. Teplota tání klatrátů (Tm-CLA) je úměrná množství rozpuštěných solí (podobně jako Tm-ice) a používá se proto k určování salinity (viz. níže).
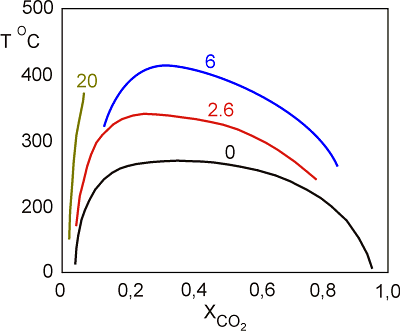
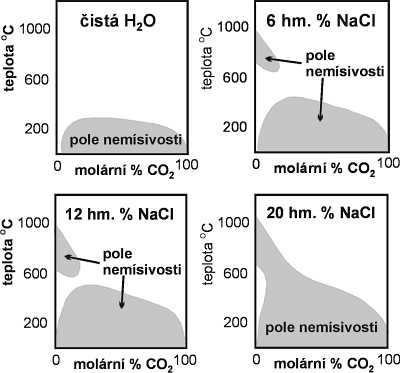
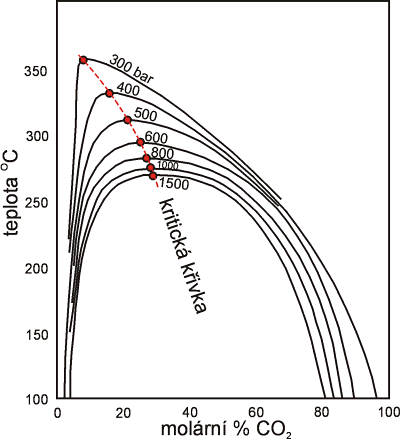
Dalším významným rysem systému H2O - CO2 ± soli je poměrně rozsáhlá oblast vzájemné nemísivosti mezi H2O a CO2 bohatými kapalinami (LAQ a LCAR). Rozsah nemísivosti je funkcí mnoha parametrů z nichž nejvýznamnější jsou: koncentrace rozpuštěných solí (Obr. 21, 22), tlak (Obr. 23), teplota a příměs dalších plynů (hl. CH4).
Obr. 21. Vliv koncentrace rozpuštěných solí (čísla u křivek znamenají hm. % NaCl) na tvar a rozsah H2O - CO2 solvu a vzájemné nemísivosti H2O a CO2 bohatých fluid.
| Návrat na Obsah |
| 7.3.1. Mikrotermometrická měření |
Pro účely mikrotermometrie je vhodné rozdělit H2O - CO2 (H2O - CO2 - NaCl) systém na 4 části s vymezenými variacemi molárního zlomku XH2O (XCO2 = 1 - XH2O). Níže uvedená tabulka (Tab. 8) uvádí sled fázových změn v inkluzích s vymezeným obsahem vodné fáze:
Obr. 22. Vliv koncentrace rozpuštěných solí na tvar a rozsah H2O - CO2 solvu a vzájemné nemísivosti H2O a CO2 bohatých fluid.
Obr. 23. Vliv tlaku na rozsah nemísivosti v H2O - CO2 systému.
Tab. 8. Sled měřitelných fázových změn v inkluzích typu H2O - CO2 (Existuje více možných sledů fázových přeměn (zejména za nízkých teplot), níže uvedené jsou však nejčastější.).
| XH2O | sled měřitelných teplot fázových změn | pozn. | |
| I. | > 0.985 | Tm-ice ® Th-tot | Existence CO2 je mikrotermometricky neidentifikovatelná, soustava se chová jako H2O systém. Epitermální fluida. |
| II. | Tm-ice ® Tm-CLA ® Th-CO2 ® Th-tot | Nízko až středně metamorfní fluida a mesotermální hydrotermální fluida. Může být i Th-CO2 ® Tm-CLA. | |
| III. | Tm-CO2 ® Tm-CLA ® Th-CO2 ® Th-tot | Výše metamorfní fluida, intrusivní prostředí, pegmatity. Může být i Th-CO2 ® Tm-CLA. | |
| IV. | < 0.002 | Tm-CO2 ® Th-CO2 | Existence H2O je mikrotermometricky neidentifikovatelná, soustava se chová jako CO2 systém |
| Návrat na Obsah |
| 7.3.2. Určování salinity |
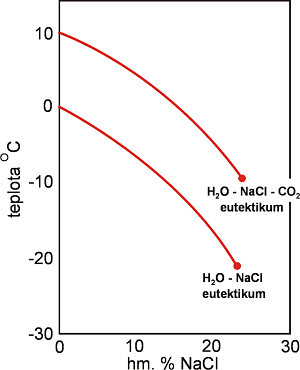
Jak již bylo řečeno k určování salinity se u smíšených H2O - CO2 roztoků nepoužívá teplota tání posledního krystalu ledu (Tm-ice), ale teplota tání klatrátu (Tm-CLA). V soustavě H2O - CO2 bez jakýchkoli dalších příměsí je teplota tání klatrátu určena teplotou čtverného budu Q2 (Tm-CLA = +10.1 °C). Přítomnost solí snižuje Tm-CLA: čím vyšší koncentrace solí, tím nižší je Tm-CLA. Podobně jako Tm-ice ve vodných systémech je Tm-CLA funkcí nejen koncentrace (Obr. 24), ale i typu sole (solí). Více informací viz.: Diamond (1992).
Obr. 24. Vliv koncentrace NaCl na teplotu tání klatrátu CO2. Pro srovnání je uvedena i křivka pro tání ledu ve vodném systému.
Při mikrotermometrickém měření teploty klatrátu je nutno rozlišovat mezi 4-složkovou asociací (CO2-klatrát + CO2(L) + CO2(V+) + LAQ) a 3-složkovými asociacemi ve kterých dochází k tání klatrátu za absence buď kapalného /CO2(L)/, nebo plynného /CO2(V)/ CO2. Ve třísložkové asociaci je totiž teplota homogenizace CO2 nižší než teplota tání klatrátu (Th-CO2 < Tm-CLA). Diamond (1992) navrhl proto postup, kdy je nutné nejdříve změřit Th-CO2 (za podmínek podchlazení inkluze a to do teploty než dojde k metastabilní nukleaci klatrátu CO2 – což v praxi znamená asi do –20 °C), později pak Tm-CLA (během zahřívání). V případě trojsložkové asociace je nutno rozlišovat zda CO2 homogenizuje na plyn či kapalinu. Rovnice pro výpočet salinity shrnuje tabulka 9.
Problémem, který je neřešitený bez speciálních analytických metod, je podstatnější příměs dalších plynů v CO2. Tyto plyny zvyšují teplotu Tm-CLA, tzn. že působí opačně proti vlivu koncentrace rozpuštěných solí ve vodné fázi. Pro nízkokoncentrované roztoky tohoto typu, může být Tm-CLA i vyšší než +10.1 °C. Pokud příměs dalších plynů v CO2 je značná, nebo pokud Tm-CLA > +10.1 °C (v případě 4-složkové asociace), nelze použít pro výpočet salinity použít rovnic uvedených v tab. 10 (Pozn.: Příměs dalších plynů v CO2 je zřejmá již z nižší hodnoty Tm-CO2, která není závislá na koncentraci solí.).
Tab. 9. Rovnice pro výpočet salinity na základě tání klatrátu CO2.
| Systém | Rovnice pro výpočet salinity (S) v hm. % příslušné soli: | Platnost (hm. %) |
| 4-složkové asociace tání klatrátu (CO2-klatrát + CO2(L) + CO2(V) + LAQ) | ||
| NaCl - H2O - CO2 | S = 15.6192 - 1.1406 Tm-CLA - 0.035 (Tm-CLA)2 - 0.0007 (Tm-CLA)3 | 0 - 24.2 |
| CaCl2 - H2O - CO2 | S = 19.16 - 1.102 Tm-CLA - 0.0754 (Tm-CLA)2 | 0 - 21.0 |
| KCl - H2O - CO2 | S = 20.30 - 1.519 Tm-CLA - 0.0511 (Tm-CLA)2 | 0 - 18.5 |
| 3-složková asociace tání klatrátu (CO2-klatrát + CO2(L) + LAQ), homogenizace CO2 na kapalinu | ||
| S = 15.6151 - 0.03627 X + 0.00164 X2 - 0.9491 Tm-CLA - 0.00287 X Tm-CLA - 0.02464 (Tm-CLA)2 - 0.00107 X (Tm-CLA)2 - 0.00222 (Tm-CLA)3 (X = metastabilní Th-CO2(L): -20 až +10°C, měřená za absence klatrátu) (pro Tm-CLA v rozmezí -5 až +13°C) | 0 - 21.0 | |
| 3-složková asociace tání klatrátu (CO2-klatrát + CO2(V) + LAQ), homogenizace CO2 na plyn | ||
| S = 15.5131 - 0.065705 X - 0.00778 X2 - 1.05135 Tm-CLA + 0.02687 X Tm-CLA - 0.04717 (Tm-CLA)2 + 0.00138 X (Tm-CLA)2 - 0.00411 (Tm-CLA)3 (X = metastabilní Th-CO2(V): -20 až +10°C, měřená za absence klatrátu) (pro Tm-CLA v rozmezí -8 až +10°C) | 0 - 21.0 | |
| Předchozí stránka | Obsah textu | Následující stránka |
| FLUIDNÍ INKLUZE - úvodní stránka | ||