| FLUIDNÍ INKLUZE - úvodní stránka | ||
| Předchozí stránka | Obsah textu | Následující stránka |
| 7. Základy mikrotermometrie |
| FLUIDNÍ INKLUZE - úvodní stránka | ||
| Předchozí stránka | Obsah textu | Následující stránka |
| 7. Základy mikrotermometrie |
Mikrotermometrie zahrnuje identifikaci fázových změn v inkluzi a přesné určení teplot těchto změn. Tepelný rozsah měření je předurčen použitým chladícím mediem (nejčastěji kapalný dusík, ~ -190°C) a typem aparatury (obvykle do +600°C, ve speciálních případech až 1500°C).
Pozorování v oblasti nízkých teplot (< 0°C) se označují souborně termínem kryometrie, v oblasti vyšších teplot jako homogenizace. Obvykle se nejdříve provádí pozorování při nízkých teplotách a později při vyšších. Pouze v případě snadno štěpných minerálů (karbonáty, baryt, fluorit) je vhodné postup obrátit, neboť při vymrazování může dojít k částečnému porušení hermetičnosti inkluze vlivem tlaku vzniklého ledu. Následně měřené teploty homogenizace by byly pak vyšší než skutečné.
Měření teplot fázových změn při kryometrii se neprovádí při procesu vymrazování, ale teprve až při následném zahřívání již vymrazené inkluze. Důvodem je, že při vlastním vymrazování mají fázové změny většinou metastabilní charakter (tzn., že teplota nukleace fáze při vymrazování se nerovná teplotě jejího tání/homogenizace při ohřívání).
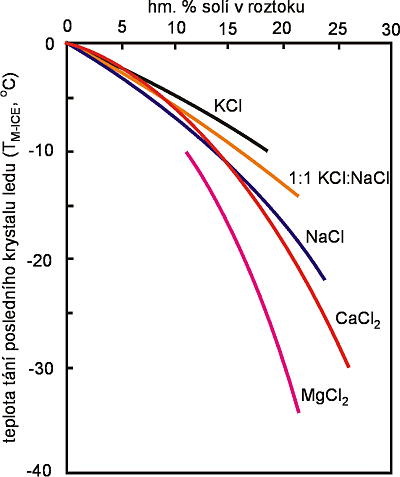
Koncentrace solí rozpuštěných (salinita) se obvykle udává v hm. % NaClekv. (NaCl-ekvivalent). Je definována jako koncentrace NaCl určená podle teploty tání posledního krystalu ledu (Tm-ice). Tzn., že je zanedbán vliv ostatních elektrolytů (solí) na tání ledu (Tm-ice). Pro většinu solí, zejména v případě jejich nízké koncentrace, je rozdíl mezi koncentrací solí odhadnutou jako hm. % NaClekv. a koncentrací skutečnou minimální (Obr. 8). Většina přírodních vodných roztoků obsahuje obvykle směs solí, z nichž jedna je téměř vždy NaCl. Proto mohou být kryometrická měření aproximována binární soustavou H2O - NaCl, případně ternárními soustavami H2O - NaCl - CaCl2 či H2O - NaCl - KCl.
Obr. 8. Vliv koncentrace a různých typů elektrolytů ve vodném roztoku na teplotu tání posledního krystalu ledu (Tm-ice), resp. rovnovážnou teplotu tuhnutí roztoku.
| Návrat na Obsah |
| 7.1. Vodné roztoky (bez přítomnosti plynů typu CO2, N2, CH4, ...) |
| 7.1.1. Fázové vztahy za nízkých teplot (kryometrie) |
| 7.1.1.1. H2O - NaCl |
Fázové vztahy ve vodném roztoku NaCl v závislosti na jeho teplotě a koncentraci uvádí Obr. 9. Vzhledem k sledu fázových změn a typu fází lze diagram rozdělit na čtyři intervaly podle salinity (0-23.3; 23.3-26.3; 26.3-61.9; >61.9 hm. % NaCl). Plynná fáze (vodní pára) není v diagramu a ani v textu uvedena, ale je vždy přítomna. Fázové vztahy shrnuje též tab. 3.
Při teplotě nižší než je teplota eutektika (-21.2 °C) existují v systému pouze pevné fáze a pára. Pro rozsah salinit od 0 do 61.9 hm. % NaCl jsou to led a hydrohalit /NaCl * 2H2O/, při salinitě větší než 61.9 hm. % je to halit (NaCl) a hydrohalit. Při teplotách vyšších spolu koexistují kapalina a pevná fáze (led, hydrohalit, nebo halit). Po roztání pevných fází zbude kapalina a pára.
Fázové změny v inkluzi (během ochlazování/zahřívání) probíhají v uzavřeném systému. Na uvedeném diagramu odpovídají změnám na liniích paralelních s teplotní osou. Pro výše uvedené intervaly salinit jsou tyto změny schematicky znázorněny liniemi A, B, C, D (koncentrace 10, 25, 30 a 65 hm. % NaCl). Fázové změny budou popsány v sledu jak následují při zahřívání zcela vymrazeného roztoku.
Obr. 9. Fázové vztahy v párou nasyceném systému H2O - NaCl. Linie A, B, C, D představují čtyři inkluze o různé salinitě a odlišném sledu fázových změn (viz. text). Body v grafu: E-eutektikum, P-peritektikum, M-metastabilní eutektikum (-28°C).
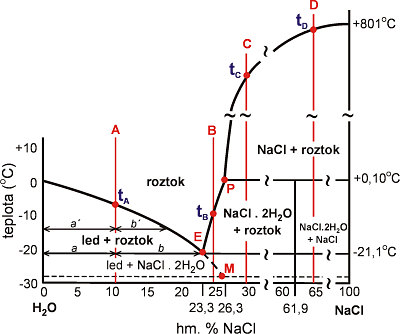
linie A)
Při teplotě -21.2°C (Te) náhle roztaje všechen hydrohalit. V inkluzi zbude led a voda, jejich vzájemný poměr udává pákové pravidlo (poměr vzájemného množství ledu a vody odpovídá poměru úseček a/b). Po krátkou dobu tání hydrohalitu (Te) spolu koexistují tři fáze: led, hydrohalit a voda. Koncentrace NaCl ve vzniklé kapalině odpovídá salinitě eutektického složení (23.3 hm. % NaCl).
Při dalším zahřívání postupně roztává led a narůstá množství vody. Jejich vzájemný poměr stále udává pákové pravidlo (a'/b') a koncentrace NaCl v kapalné fázi se postupně snižuje. Při teplotě (tA) roztaje poslední krystal ledu a zbude pouze kapalina. Podle teploty tA se určí koncentrace NaCl v roztoku (inkluzi).
Bodnar (1993) navrhl revidovanou rovnici pro výpočet salinity v systému H2O - NaCl podle teploty tání ledu (Tm-ice):
Salinita (hm. % NaCl) = 0.00 + 1.78 q - 0.0442 q 2 + 0.000557 q3
kde q = ½ Tm-ice½
Rovnice platí pro rozmezí salinit 0 až 23.2 hm. % a teplotu tání ledu 0 až –21.2 °C. Používá se též obecně pro výpočet hm. % NaClekv..
linie B)
Při teplotě -21.2 °C (Te) náhle roztaje všechen led a v inkluzi zbude hydrohalit a voda. Vzájemné množství vody a hydrohalitu odpovídá poměru úseček c/d. Při dalším zahřívání postupně taje hydrohalit a narůstá množství vody. Při teplotě (tB) roztaje poslední krystal hydrohalitu a zbývá pouze voda.
linie C)
Tato inkluze se odlišuje od obou předchozích přítomností krychlového různě velkého krystalu halitu za teploty > +0.1 °C v inkluzi. Při teplotě -21.2 °C (Te) roztaje všechen led a zbude hydrohalit a voda. Při dalším zahřívání postupně roztává malé množství hydrohalitu až náhle při teplotě +0.10 °C roztaje všechen hydrohalit. Nad touto teplotou existuje vodný roztok nasycený NaCl. Množství NaCl, které za dané teploty převyšuje rozpustnost NaCl ve vodě, tvoří krystal halitu (NaCl). Krystal halitu se při zvyšování teploty postupně rozpouští, až za teploty tC je v inkluzi přítomna pouze kapalná a plynná fáze.
Salinita roztoku se určuje podle teploty rozpuštění halitu (Ts-NaCl), podle rovnice, kterou navrhli Sterner et al. (1988):
Salinita (hm. % NaCl) = 26.242 + 0.4928 Y + 1.42 Y2 - 0.223 Y3 + 0.04129 Y4 + 6.295 x 10-3 Y
5 - 1.967 x 10-3 Y6 + 1.1112 x 10-4 Y7
(Kde Y = Ts-NaCl (°C)/100)
Linie D)
V této inkluzi za pokojové teploty je přítomen velký krystal halitu. Při úplném vymrazení jsou v inkluzi přítomny hydrohalit a halit. Při teplotě -21.2 °C (Te) a ani při dalším zahřívání se nic neděje. Teprve při teplotě peritektika (+0.10 °C) roztaje všechen hydrohalit, zbude halit a kapalina. Halit se při dalším zvyšování teploty postupně rozpouští, až za teploty TD je v inkluzi přítomna pouze kapalná (a plynná) fáze. Salinita se určuje dle rovnice uvedené u linie C.
Většina inkluzí v přírodních vzorcích odpovídá typu A, nebo typu C. Typy B i D jsou poměrně vzácné. Rozlišení typů A a B spočívá pouze v identifikaci pevné fáze která existuje nad eutektickou teplotou (Te), zda led či hydrohalit. Vybrané charakteristiky pevných fází sloužící k jejich mikroskopické identifikaci uvádí Tab. 5. Podobně lze popsat i chování dalších systémů, např. H2O - CaCl2, fázové změny však mohou být komplikovanější (více typů pevných fází).
Tab. 3. Sled fázových změn v párou nasyceném H2
| Salinita (S) (hm. % NaCl) | Sled fázových změn (z podmínek úplného vymrazení) |
| S = 0 | I+V ® I+L+V (0°C) ® L+V |
| 0 < S < 23.2 | I+HH+V ® I+HH+Le+V (-21.2°C) ® I+L+V ® L+V |
| S = 23.2 | I+HH+V ® I+HH+Le+V (-21.2°C) ® L+V |
| 23.2 < S < 26.3 | I+HH+V ® I+HH+Le+V (-21.2°C) ® HH+L+V ® L+V |
| S = 26.3 | I+HH+V ® I+HH+Le+V (-21.2°C) ® HH+L+V ® HH+Lp+V (+0.1°C) ® L+V |
| 26.3 < S < 61.9 | I+HH+V ® I+HH+Le+V (-21.2°C) ® HH+L+V ® HH+Lp+V (+0.1°C) ® H+L+V ® L+V |
| S > 61.9 | HH+H+V ® HH+H+Lp+V (+0.1°C) ® H+L+V ® L+V |
| Návrat na Obsah |
| 7.1.1.2. H2O - NaCl - CaCl2 |
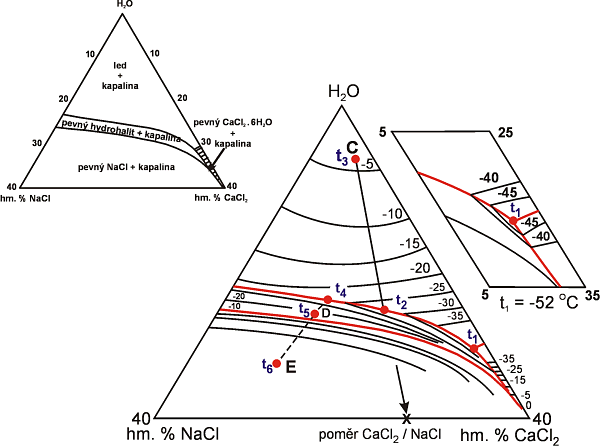
Příklad fázových změn v ternárním systému. Za podmínek odpovídajících Obr. 10. jsou při úplném vymrazení (za teplot nižších než Te = -55 °C) přítomny 3 pevné fáze (led /H2O/, hydrohalit /NaCl*2H2O/ a antarkticit /CaCl2*6H2O/). Při dosažení teploty eutektika (Te) jedna z nich roztaje. Podle toho která to je a která fáze taje jako další v pořadí mohou nastat situace 1 až 4 pro nenasycené roztoky a 5 pro přesycené roztoky s přítomností pevné fáze za pokojové teploty:
Obr. 10. Fázové vztahy v systému H2O - NaCl - CaCl2 (párou nasyceném) spolu se schematickým znázorněním tání v inkluzích rozdílného složení (C,E,D). (Podle Shepherd et al. 1985)
| Návrat na Obsah |
| 7.1.1.3. Stručné shrnutí a praktické rady |
Teplota eutektika (Te) je charakteristická pro každý jednotlivý systém (Tab. 4). Závisí pouze na typu rozpuštěných solí a nikoli na jejich koncentraci, či vzájemných poměrech. Slouží proto k přibližné identifikaci typu solí přítomných v inkluzi. Teploty eutektika lze pro praktické účely shrnout do několika skupin:
| Te (°C) | ||
| 1. | roztoky obsahující Li | -74.8 až -78.0 |
| 2. | roztoky obsahující CaCl2 | -49.8 až -55.0 |
| 3. | roztoky obsahující MgCl2, FeCl2, FeCl3 | -35.0 až -38.0 |
| 4. | roztoky obsahující NaCl (bez LiCl, CaCl2, MgCl2, FeCl2, FeCl3) | -21.2 až -23.5 |
| 5. | KCl - H2O systém | -10.6 |
| 6. | sulfátové a karbonátové roztoky | -1.2 až -5.8 |
Ne vždy lze Te změřit zcela přesně a velmi často ji nelze změřit vůbec (velmi malé inkluze, obtížně průhledné vzorky, apod.). Změřená teplota může být proto i mírně vyšší než skutečná Te. V případě metastabilního tání však může být naměřená teplota naopak nižší než rovnovážná Te (zejména teploty nižší než -60°C mohou představovat metastabilní tání roztoků s CaCl2).
Pokud je Te při prvém zahřívání vymrazené inkluze obtížně určitelná lze postupovat následovně: inkluzi zahřát až na teplotu jen o málo nižší, než je teplota tání posledního krystalu ledu (Tm-ice), tak aby v ní zbyl pouze jediný krystal ledu. Při opětovném ochlazení nový led netvoří samostatná krystalizační centra, ale krystalizuje na povrchu starého ledového krystalu. Při úplném vymražení může takto dojít k výraznému prostorovému oddělení krystalů ledu a pevných hydrátů v inkluzi. Při novém zahřívání je pak prvé tání (Te) omezeno pouze na část objemu inkluze a tudíž i lépe pozorovatelné.
Teplota tání hydrátů solí (Tm-h) je často obtížněji rozeznatelná než Te. Je důležitá pro přibližnou interpretaci poměru solí ve vícesložkových systémech (viz. příklad H2O - NaCl - CaCl2). Teploty tání hydrátů je zapotřebí měřit vždy na co nejmenších krystalech/zrnech (vzniknou při prudkém ochlazení). Velké krystaly hydrátů se při zahřívaní chovají metastabilně a tají při vyšších teplotách než odpovídá skutečnému složení roztoku.
Teplota tání posledního krystalu ledu (Tm-ice) ve většině případů slouží k určení salinity roztoku. K snadnému a přesnému určení Tm-ice je možno vypěstovat si velké krystaly ledu: vymrazená inkluze se zahřeje tak aby roztála většina ledových krystalků a zbyly pouze 1-2 krystaly ledu. Pak se znovu ochladí, zpočátku pomaleji, později lze i rychleji.
Tab. 4 Charakteristické teploty eutektika (Te) vodných roztoků
| Systém: | Te (°C) | Odkaz |
| H2>O - NaCl | -21.1 | Borisenko 1977 |
| H2O - KCl | -10.6 | Borisenko 1977 |
| H2O - NaCl - KCl | -23.0 | Borisenko 1977 |
| H2O - MgCl2 | -33.6 | Borisenko 1977 |
| H2O - FeCl2 | -35.0 | Borisenko 1977 |
| H2O - NaCl - MgCl2 | -35.0 | Borisenko 1977 |
| H2O - NaCl - FeCl2 | -37.0 | Borisenko 1977 |
| H2O - CaCl2 | -49.5 | Borisenko 1977 |
| H2O - KCl - CaCl2 | -50.5 | Borisenko 1977 |
| H2O - NaCl - CaCl2 | -52.0 | Crawford 1981 |
| H2O - NaCl - CaCl2 | -55.0 | Borisenko 1977 |
| NaCl - Na2CO3 - H2O | -21.4 | Borisenko 1977 |
| NaCl - Na2SO4 - H2O | -21.5 | Borisenko 1977 |
| NaCl - NaHCO3 - H2O | -21.8 | Borisenko 1977 |
| Na2CO3 - NaHCO3 - H2O | -3.3 | Borisenko 1977 |
| Na2CO3 - H2O | -2.1 | Borisenko 1977 |
| NaHCO3 - H2O | -2.3 | Borisenko 1977 |
| Na2SO4 - H2O | -2.1 | Borisenko 1977 |
| Na2SO4 - K2SO4 - H2O | -2.7 | Borisenko 1977 |
Tab. 5 Mikroskopické charakteristiky sloužící k identifikaci pevných fází:
| Fáze (název) | kryst. soustava, vzhled | charakter (index lomu) | Poznámka: |
| NaCl ž 2H2O (hydrohalit) |
monoklinický; jemnozrnná zrna skvrnitého vzhledu | izotropní (1.461) |
vzhledem k ledu má vysoký reliéf |
| CaCl2 ž 6H2O (antarkticit) |
? podobný hydrohalitu, vzácněji též zaoblená zrna | bezbarvý | |
| MgCl2 ž 12H2O | ? podobný hydrohalitu | ||
| KCl ž H2O | ? | anizotropní (?) |
|
| Na2CO3 ž 10H2O | Rombický | (1.440-1.406) | |
| Na2SO4 ž 10H2O | izometrický | (1.395-1.392) | |
| NaCl (halit) | Kubický | izotropní (1.544) |
|
| KCl (sylvín) | Kubický | izotropní (1.490) |
|
| NaHCO3 | jehličkovitý | (1.583-1.377) |
| Předchozí stránka | Obsah textu | Následující stránka |
| FLUIDNÍ INKLUZE - úvodní stránka | ||