| FLUIDNÍ INKLUZE - úvodní stránka | ||
| Předchozí stránka | Obsah textu | Následující stránka |
| 7.1.2. Fázové změny za vyšších teplot (homogenizace) |
| FLUIDNÍ INKLUZE - úvodní stránka | ||
| Předchozí stránka | Obsah textu | Následující stránka |
| 7.1.2. Fázové změny za vyšších teplot (homogenizace) |
| 7.1.2.1. Homogenizace plynné a kapalné fáze |
Rozeznávají se tři způsoby homogenizace plynokapalné fáze: na kapalinu, na plyn (páru) a kritický způsob.
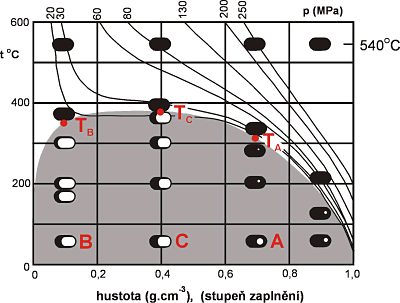
Nejlépe lze změny během homogenizace znázornit na diagramu (Obr. 11) teplota (či tlak) versus hustota fluidní fáze (resp. molární objem - jež je reciprokou hodnoty hustoty, nebo složení fluidní fáze vyjádřené v molárních procentech/zlomku – např. u H2O - CO2 fluid). V této projekci probíhají všechny změny v inkluzi po linii (dle dané hustoty/složení), která je paralelní s teplotní (tlakovou) osou.
V PT projekci (Obr. 12) vývoj v inkluzi sleduje nejprve křivku koexistence kapalné a plynné fáze; v okamžiku homogenizace se od této křivky odděluje a pokračuje dále po příslušné isochoře.
Z obou typů diagramů je patrné, že inkluze homogenizující na plyn, bývají zachyceny za podstatně nižších tlaků, než inkluze homogenizují na kapalinu.
Obr. 11. Schematické znázornění fázových změn v inkluzích uzavřených za stejné teploty (540°C), ale při rozdílném tlaku (podle Roedder 1984). Při pokojové teplotě se inkluze liší stupněm zaplnění a celkovou hustotou uzavřeného fluida. Inkluze typu A homogenizují na kapalinu, typu B na plyn, typu C kritickým způsobem. Šedé pole značí oblast nemísivosti plynné a kapalné fáze. V tomoto poli znamená černá barva inkluzí kapalinu a bílá plyn. Nad polem nemísivosti černá barva inkluzí znamená homogenní fázi (nadkritickou tekutinu).
Obr. 12. Schematické znázornění vztahů v H2O systému. Tučná linie značí křivku koexistence plynu (páry) a kapaliny, tenké linie representují isochory pro fluida o příslušné hustotě (g/cm3), C.P. = kritický bod. Šipkami je znázorněn PT vývoj během homogenizace inkluzí typu A (homogenizuje na kapalinu) a typu B (homogenizuje na plyn). Původní podmínky vzniku inkluzí A a B reprezentují body X a Y. Z obrázku vyplývá i rozdíl mezi podmínkami vzniku (Tt, Pt) a homogenizace (Th, Ph) inkluze.
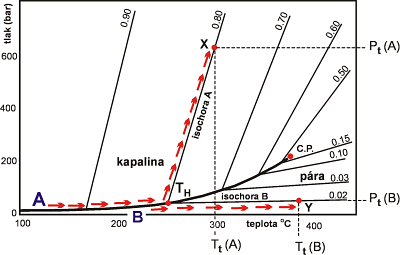
Teplota (Tt) a tlak při vzniku (zachycení) inkluze z homogenní fluidní fáze je vždy vyšší než teplota její homogenizace; PT podmínky zachycení inkluze leží na příslušné isochoře (Tt > Th). Pouze v případě zachycení inkluzí z heterogenního fluida, např. za podmínek varu roztoku, se teplota homogenizace rovná teplotě vzniku inkluze (Th = Tt). Inkluze vzniklé v podmínkách varu roztoku se vyznačují koexistencí plynných, resp. plynem bohatých a kapalinou bohatých inkluzí. Přitom teploty obou způsobů homogenizace inkluzí (na plyn a kapalinu) by měly být více, či méně identické.
| Návrat na Obsah |
| 7.1.2.2. Homogenizace inkluzí obsahujících plynnou, kapalnou a pevnou fázi |
Rozeznávají se tři základní způsoby homogenizace inkluzí obsahujících kromě plynné a kapalné též pevnou fázi (dceřiný minerál). Vztahy budou vysvětleny na příkladu systému H2O - NaCl (Bodnar 1994). Symbol pevné fáze (S) reprezentuje v tomto případě halit (NaCl). Jednotlivé způsoby homogenizace se liší sledem fázových změn (Obr. 13):
Obr. 13. PT diagram zobrazující tři možné způsoby homogenizace inkluze obsahující roztok o koncentraci 40 hm. % NaCl, v závislosti od toho při jakých PT podmínkách byla zachycena (podle Bodnar a Vityk in De Vivo a Frezzotti (1995). V inkluzi typu "A" se nejprve rozpustí halit (323°C), pak zhomogenizují plynná a kapalná fáze na kapalinu (500°C). V inkluzi typu "C" dojde nejprve k homogenizaci plynné a kapalné fáze (za přítomnosti halitu) na kapalinu (~ 200°C) a posléze k rozpuštění halitu (~ 300°C, bod X). V inkluzi typu "B" všechny fáze zhomogenizují v jednom okamžiku (při 323°C).
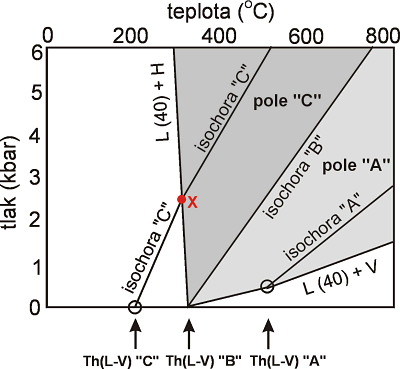
Konkrétní PT podmínky zachycení jakékoli inkluze leží na odpovídající isochoře. Přesný průběh isochor (resp. iso-Th linií) je však znám pouze pro inkluze homogenizující prvým (resp. druhým) způsobem a pouze pro roztoky NaCl a koncentrace £ 40 hm. %. Experimentální data pro třetí způsob homogenizace jsou ojedinělá (40 hm. % NaCl – Bodnar 1994, 35 hm. % NaCl – Bodnar a Vityk in De Vivo a Frezzotti (1995) a zahrnují pouze sklon isolinií parciální homogenizace (mezi body X a Th(L-V) "C"). Nad bodem X jejich přesný průběh není zatím znám.
Salinita fluidní fáze se ve všech třech případech určuje podle teploty tání (rozpuštění) pevné fáze (Ts). Pro systém H2O - NaCl platí následující rovnice (Sterner et al. 1988) pro rozpustnost NaCl ve vodě v rozmezí teplot od peritektika (+0.1°C) po trojný bod NaCl (+801°C):
Salinita (hm. % NaCl) = 26.242 + 0.4928 Y + 1.42 Y2 - 0.223 Y3 + 0.04129 Y4 + 6.295 x 10-3 Y5 - 1.967 x 10-3 Y6 + 1.1112 x 10-4 Y7
(Kde Y = Ts-NaCl (°C)/100)
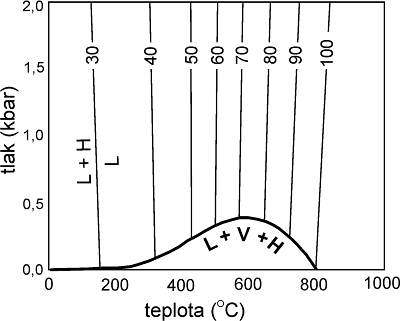
Rovnici nelze aplikovat na systémy, kde vedle NaCl je přítomen ještě jiný dceřiný minerál. V případě homogenizace typu ad A, ad B se vypočtená salinita vždy rovná salinitě skutečné. V případě ad C toto platí pouze pro roztoky o salinitě 50 hm. % (resp. blízké tomuto složení). Pro roztoky o salinitě nižší než 50 hm. % je skutečná salinita nižší než vypočtená, pro roztoky o salinitě vyšší je vyšší než vypočtená. Rozdíl může být až několik hm. %. Důvodem je rozdílný sklon linií likvidu (L+S® L) pro různé koncentrace NaCl (Obr. 14). Sklon linií likvidu je dán vztahem (Bodnar 1994):
dT/dP (°C/kbar) = -38.38 + 0.90 S - 0.0029 S
(Kde S = salinita v hm. % NaCl)
Obr. 14. Průběh křivek likvidu halitu v systému H2O - NaCl (pro 30 až 100 hm. % NaCl), podle Bodnar a Vityk in De Vivo a Frezzotti (1995).
| Návrat na Obsah |
| 7.1.2.3. Salinita inkluzí s dvěma dceřinými minerály (H2O - NaCl - KCl systém) |
Fázové vztahy v párou saturovaném systému H2O - NaCl - KCl uvádí Sterner et al. 1988. Za vyšších teplot jsou v inkluzi přítomny dvě pevné fáze - halit (NaCl) a sylvín (KCl). Plynná a kapalná fáze homogenizují vždy za teplot vyšších než je teplota rozpuštění halitu (Ts-NaCl) i sylvínu (Ts-KCl). Popisované vztahy jsou analogické situaci "A" (systém H2O - NaCl, obr. 13).
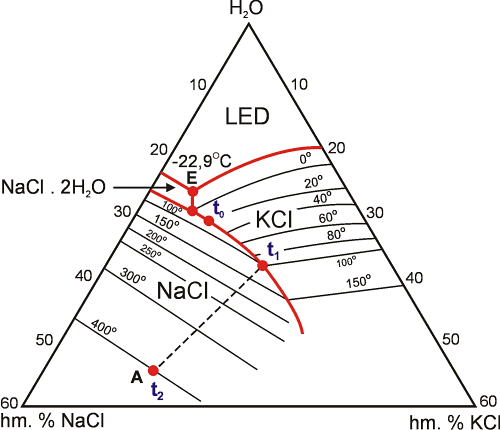
Fázové vztahy za nízkých teplot jsou v následujícím popisu vynechány, pro určení salinity nejsou podstatné. Za vyšších teplot dochází k rozpouštění obou pevných fází (Obr. 15). Do doby než dojde k úplnému rozpuštění jedné z nich, se složení (salinita) kapalné fáze vyvíjí podél kotektické linie mezi polem KCl a NaCl (z bodu t0 do t1). Od okamžiku roztání jedné z fází (v daném případě KCl, bod t1) se složení roztoku dále vyvíjí po spojnici mezi fází která taje (v našem případě NaCl; NaCl vrchol však leží mimo zobrazenou oblast, spojnice proto nesměřuje do vrcholu zobrazeného trojúhelníka) a bodem roztání prvé pevné fáze (t1). K určení toho, která z obou kubických fází taje, může pomoci skutečnost, že sylvín taje rychleji než halit a že krystaly sylvínu mívají často zaoblené okraje. V okamžiku, kdy roztaje i zbývající pevná fáze (NaCl, bod t2), je salinita kapalné fáze již neměnná. V našem případě odpovídá 40 hm. % NaCl a 15 hm. % KCl.
Obr. 15. Výřez z projekce párou nasyceného povrchu systému H2O - NaCl - KCl. Zobrazeny jsou isotermy rozpouštění pevných fází (NaCl, KCl) a eutektický bod systému (E). Vývoj inkluze se dvěma dceřinými kubickými minerály a koncentrací 40 hm. % NaCl a 15 hm. % KCl během zahřívání z pokojové teploty na 400°C zahrnuje cestu t0 ® t1 ® t2. (Podle Shepherd et. al. 1985).
| Předchozí stránka | Obsah textu | Následující stránka |
| FLUIDNÍ INKLUZE - úvodní stránka | ||