Radikál

Reakce chemická

Reakce endotermická

Reakce exotermická

Reakce neutralizační
H3O+ + OH- → 2H2O.

Reakce redoxní

Reakce srážecí

Redukce

Retardátory hoření
polybromované bifenylethery
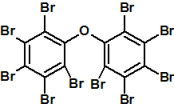
polybromované bifenylethery,
polybromované cykloalkany
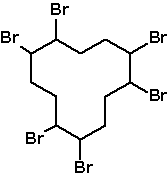
polybromované cykloalkany,
další informace (anglicky)

RNA

Rovnice směšovací
m1 + m2 = m3,
w1.m1 + w2.m2 = w3.m3. Indexy 1 a 2 se vztahují k výchozím roztokům, popř. index 2 k čisté látce nebo rozpouštědlu, index 3 k výslednému roztoku.

Rovnováhy acidobazické

Rovnováhy heterogenní

Rovnováha chemická

Rovnováhy komplexotvorné

Rovnováhy redoxní

Rovnováhy srážecí

Rozdíl potenciálový

Rozpouštědlo

Rozpouštění

Rozpustnost látky

Rozštěp energetický

Roztok

Roztok Lugolův

Roztoky kyselé

Roztoky neutrální

Roztoky zásadité

Rychlost chemických reakcí

Rychlost reakční
