Papírek jodidoškrobový

Pár elektronový

Pár redoxní

Pasivace

PCB

PCDD

PCDF

Pec oblouková

Perchloráty

Perchlorethylen

Periody

Perzistentní

Pesticidy

PFC

pH

Pigment

Plasty

Plyn třaskavý chlorový

Plyn slzný
bromaceton
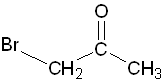
bromaceton,
CS

CS,
bromacetofenon
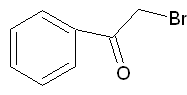
bromacetofenon,
xylylbromid
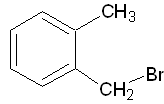
xylylbromid nebo
CN
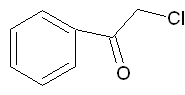
CN.

Plyny bojové

Plyny vzácné

Poločlánek

Polydentátní

Polychlorované bifenyly
obrázek
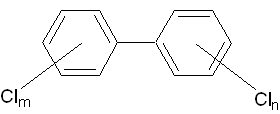
Polychlorované bifenyly,
další informace (česky)

Polyvinylchlorid
obrázek
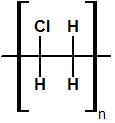
Polyvinylchlorid,
další informace (česky)

Popouštění

Ppb

Ppm

Ppt

Potenciál elektrodový

Pravidlo Hundovo

Precipitát bílý netavitelný

Precipitát bílý tavitelný

Princip akce a reakce

Princip Pauliho

Princip výstavbový

Produkt rozpustnosti

Produkty

Proton

Proud elektrický

Prvek

Prvky biogenní

Prvky d

Prvky f

Prvky nepřechodné

Prvky p

Prvky přechodné

Prvky s

PSP

PTFE

PVC

Pyrhotin

Pyrit

Pyroforický

Pyroxeny
