Vápenec

Vápno adhesivní

Vápno bělící

Vápno bromové

Vápno chlorové

Vazba dativní

Vazba donor-akceptorová

Vazba chemická

Vazba iontová

Vazba jednoduchá

Vazba koordinačně kovalentní

Vazba kovalentní nepolární

Vazba kovalentní polární

Vazba kovová

Vazba násobná

Vazba π

Vazba σ

Vazba vodíková

Vaznost atomu

Věty R a S

Vinylchlorid
viz obrázek
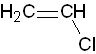
vinylchlorid
další informace (česky)

Vlastnosti látek

Voda běličská

Voda bromová

Voda chloritová

Voda chlorová

Voda jewelská

Vodič

Vodič první třídy

Vodič druhé třídy

Vtožík

Výpočty stechiometrické

Vysoká pec

Vysokomolekulární

Vysokovroucí

"Vytěsnění"

Vzorce chemické
