Salmiak

Sapolit

Sarin
obrázek
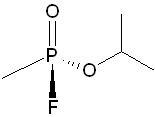
Sarin

SAVO

Siderit

Silikofluoroform

Silikochloroform

Silikojodoform

Síly soudržné

Skupenství

Skupenství kapalné

Skupenství pevné

Skupenství plynné

Skupiny prvků

Sloučenina

Sloučenina komplexní

Sloučenina koordinační

Sloučenina organokovová

Složení látek

Směs

Směs heterogenní

Směs homogenní

Soda chlorová

Sodalit

Solanka

Soli

Solík

Soluce hořečnatá

Soman
obrázek
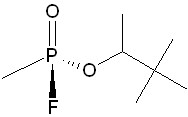
Soman
další informace (česky)

Součin rozpustnosti

Soustava

Soustava prvků periodická (periodická tabulka)

Spektrochemická řada

Stanovení

Stav excitovaný atomu

Stav základní atomu

Struktura látek

Struska

Sublimace

Sublimát
další informace (česky)

Substituce

Sůl alembrotská

Sůl Bertholettova

Sůl bromová

Sůl cínová

Sůl denaturovaná

Sůl Johnsonova

Sůl kamenná
další informace (česky)

Sůl patentní

Sůl pinková

Sůl zlatá

Sylvín
další informace (česky)

Symboly prvků

Synproporcionace

Syntéza Friedel-Craftsova
