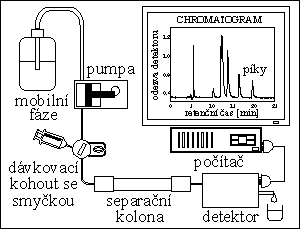
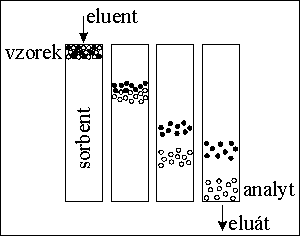
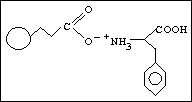
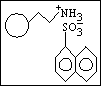
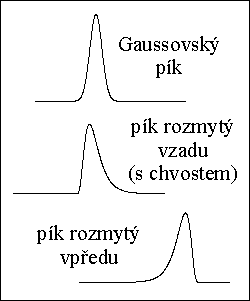
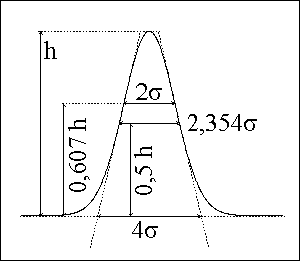
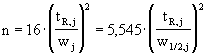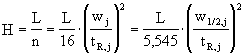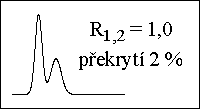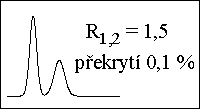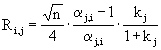kvalitativní informace :
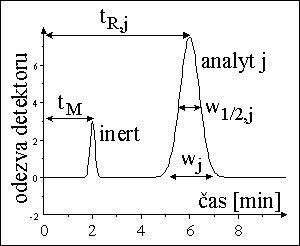
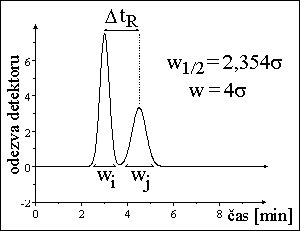
poloha píku - retenční čas → retenční faktor, distribuční konstanta - druh látky
(metoda standardů)
kvantitativní informace :
plocha píku → množství, koncentrace látky
a) metoda kalibrační přímky
b) metoda vnitřního standardu
c) metoda standardního přídavku
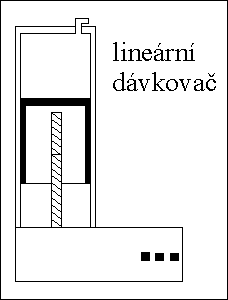
PUMPY
tlak mobilní fáze až do 40 MPa
čerpadla nebo lineární dávkovače
DÁVKOVACÍ KOHOUTY
mají dávkovací smyčku (dávkují se desítky μl)
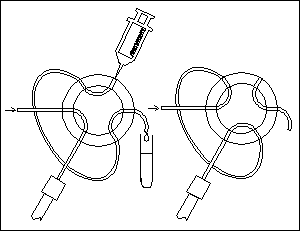
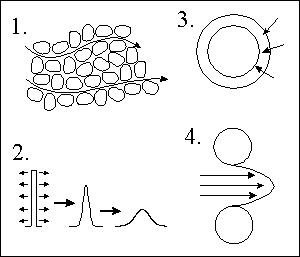
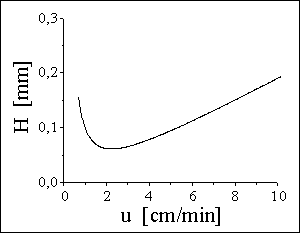
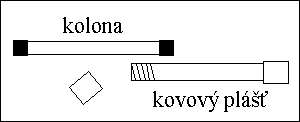
KOLONY
Rovné skleněné trubice o délce 10 až 25 cm a vnitřním průměru
3 , 4 nebo 4,6 mm naplněné sorbentem o průměru zrn 3 , 5 nebo 10 μm,
který je držen v kolně pomocí frit.
STACIONÁRNÍ FÁZE pro LSC
silikagel (oxid křemičitý) - polární, kyselý
alumina (oxid hlinitý) - polární, bazický
aktivní uhlí - téměř nepolární, jen zřídka
MOBILNÍ FÁZE pro LSC
eluční síla roste → pentan, benzen, chloroform, aceton, acetonitril, ethanol, methanol, voda
STACIONÁRNÍ FÁZE pro LLC
a) stacionární fáze mechanicky nanesené na inertním nosiči
(ethylenglycol nebo skvalan na silikagelu)
b) stacionární fáze chemicky vázané (zakotvené) na inertním nosiči (tj. silikagelu)
≡Si-C18H37 -C8H17 -(CH2)3C6H5 nepolární
-(CH2)3-CN -(CH2)3-NH2 -O-(CH2)2-OH polární
MOBILNÍ FÁZE pro LLC
a) chromatografie s normálními fázemi (stac. fáze polární a mob. fáze nepolární)
pentan, heptan, chloroform a jejich směsi
b) chromatografie s obrácenými (reverzními) fázemi (RP-HPLC)
(stac. fáze nepolární a mob. fáze polární)
methanol, acetonitril, tetrahydrofuran, voda a jejich směsi
isokratická a gradientová eluce
STACIONÁRNÍ FÁZE pro IEC
měniče iontů s nabitými funkčními skupinami
~COO- ~SO3- ~NH3+
~CH2N+(CH3)3
~SO3-H+ + Na+ ↔ ~SO3-Na+ + H+
~NH3+OH- + NO3- ↔ ~NH3+NO3- + OH-
MOBILNÍ FÁZE pro IEC
roztoky anorganických kyselin a zásad o dané iontové síle a daném pH
STACIONÁRNÍ FÁZE pro GPC, GF, SEC
polystyren zesíťovaný divinylbenzenem a silikagel o určité velikosti pórů
MOBILNÍ FÁZE pro GPC, GF, SEC
vodné pufry (např. fosforečnanový, TRIS), acetonitril a kys. trifluoroctová (TFA)
DETEKTORY
1) absorpční fotometrický detektor
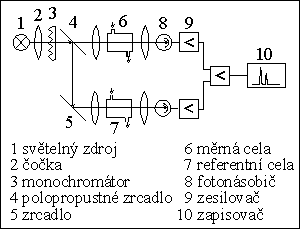
2) fluorimetrický detektor (fluorescenční det.)
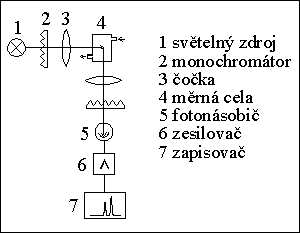
3) refraktometrický detektor
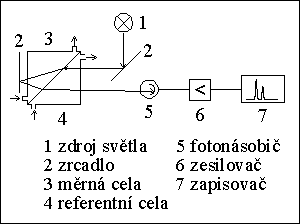
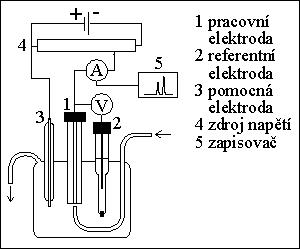
4) amperometrický detektor
5) vodivostní detektor
6) detektor s diodovým polem (DAD)
7) hmotnostní spektrometr jako detektor
HPLC FUNGICIDÙ
extrahovaných dichlormetanem z ovoce
stac. fáze : Nucleosil 7 C18
eluent : 5 g/l kys. mravenčí + NaOH (pH 7,5) 40 % se 60 % methanolu
píky : 1. thiabendazol, 2. o-fenylfenol, 3. difenylamin, 4. ethoxychin, 5. bifenyl
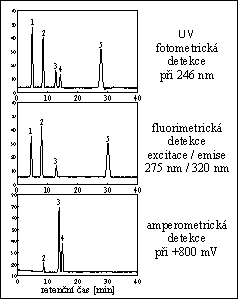
HPLC DERIVÁTÙ PURINU
kolona : 30 cm x 4 mm
stac. fáze : Nucleosil 50-5
eluent : methanol / voda / dichlormethan 47 / 17 / 936 (v/v/v)
průtok eluentu : 0,8 ml/min při tlaku 100 bar
detekce : UV fotometrická při 280 nm
píky : 1. kofein, 2. theofyllin , 3. theobromin
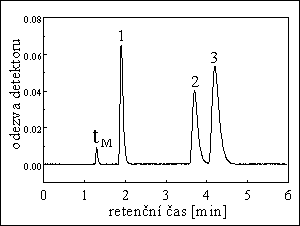
HPLC BÍLKOVIN
kolona : 25 cm x 9,4 mm
stac. fáze : Zorbax GF-250
eluent : 130 mM NaCl + 20 mM KCl + 50 mM Na2HPO4 (pH = 7,0)
průtok eluentu : 1 ml/min
detekce : UV fotometrická při 210 nm
píky :
1. myší IgM, Mh = 900 000
2. hovězí thyroglobulin, Mh = 669 000
3. β-amylasa z brambor, Mh = 200 000
4. hovězí serum albumin, Mh = 66 000
5. kuřecí albumin, Mh = 45 500
6. hovězí RNAasa, Mh = 13 700
7. azid (tmax), Mh = 65
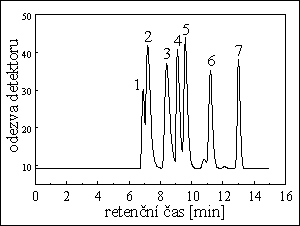
HPLC D,L ALANINU
chirální separace optických izomerů
kolona : 25 cm x 4 mm
stac. fáze : Nucleosil Chiral-1
eluent : 1 mM vodný roztok (CH3COO)2Cu (pH = 5,6)
průtok eluentu : 1,2 ml/min při tlaku 75 bar
teplota : 60 ˚C
detekce : UV fotometrická při 240 nm
píky : 1. D-alanin, 2. L-alanin
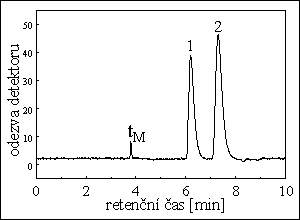
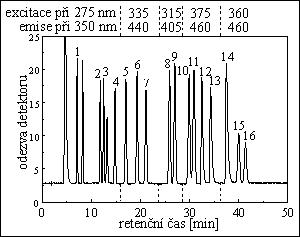
POLYAROMATICKÉ UHLOVODÍKY
kolona : 15 cm x 4 mm
stac. fáze : Nucleosil 5 C18 PAH
průtok eluentu : 0,9 ml/min při tlaku 100 bar
eluent : acetonitril / voda
5 min 60% ACN, isokraticky
60% → 90% ACN za 15 min, lineární gradient
90% → 100% ACN za 20 min, lineární gradient
20 min 100% ACN, isokraticky
detekce : fluorimetrická
píky : 1. naftalen, 2. acenaften, 3. fluoren, 4. fenanthren, 5. anthracen, 6. fluoranthen, 7. pyren,
8. benz[a]antracen, 9. chrysen, 10. benzo[e]pyren, 11. benzo[b]fluoranthen,
12. benzo[k]fluoranthen, 13. benzo[a]pyren, 14. dibenzo[ah]anthracen, 15. benzo[ghi]perylen,
16. indeno[1,2,3-cd]pyren
soubory pdf: preSM2.pdf preSM3.pdf hplcA.pdf hplcB.pdf hplcC.pdf
[ Domovská stránka |
Separační metody |
HPLC |
GC |
CES |
CZE |
MECC |
CEC |
TLC a PC |
Extrakce, GPC, IEC a AC |
Otázky |
Cvičení |
Témata |
Kvalitativní analytická chemie |
Základní praktika |
Seminář z analytické chemie |
Analytické separační metody ]
2.3.1996 © Pavel Coufal