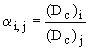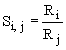ANALYTICKÁ CHEMIE
Odpovídá na otázky
Jaké látky se nachází ve vzorku?
Jaké je zastoupení těchto látek ve vzorku?
Zjišťuje tedy
kvalitativní složení vzorku (tj. druh látek) a
kvantitativní složení vzorku (tj. množství látek).
Kvalitativní analýza : důkaz, identifikace
Kvantitativní analýza : stanovení
Klasická analytická chemie
sraženiny a barevné sloučeniny
gravimetrie a volumetrie
Instrumentální analytická chemie
separační (dělící) metody
spektrometrické metody
elektrochemické metody
SEPARAČNÍ (DĚLÍCÍ) METODY
Jsou většinou založeny na rozdílné distribuci dělených látek mezi dvě různé nemísitelné fáze.
Zvyšují selektivitu a specifičnost v analytické chemii.
Lze je využít pro kvalitativní i kvantitativní analýzu (tj. důkaz, identifikaci a stanovení).
srážení, elektrodepozice, krystalizace, sublimace, destilace, dialýza, extrakce
elektromigrační metody
chromatografie
a) plynová (GC) (adsorpční a rozdělovací)
b) superkritická fluidní (SFC)
c) kapalinová (LC)
- kolonová (HPLC)
(adsorpční, rozdělovací, gelová, afinitní a iontově výměnná)
- planární (plošná)
(papírová (PC) a tenkovrstvá (TLC))
ZÁKLADNÍ POJMY
Fáze je homogenní část heterogenního systému oddělená od okolí ostrým fázovým rozhraním. (mobilní a stacionární fáze)
Separace (dělení) je proces oddělování jednotlivých složek nějaké směsi za účelem získání čistých složek.
Adsorpce je děj probíhající na fázovém rozhraní tekutina/tuhá fáze, při němž se na povrchu tuhé fáze koncentruje jedna nebo více složek tekuté fáze.
(adsorbent a adsorbát)
Absorpce (rozpouštění) je děj probíhající na fázovém rozhraní, při němž dochází k nahromadění látky nebo látek uvnitř kondenzované fáze.
(absorbent a absorbát)
Sorpce je společné označení adsorpce a absorpce. Je reverzibilní a jejím opakem je desorpce. (sorbent a sorbát)
Při chemisorpci se uplatňují nejen fyzikální síly, ale i síly chemické.
Obecně je ireverzibilní.
Fázová rovnováha je stav soustavy, při němž jsou všechny její fáze v rovnováze.
Distribuce (rozdělování) je jev, při němž se látka rozděluje mezi dvě fáze, které jsou ve vzájemném styku.
Rozdělovací rovnováha je stav soustavy, při kterém se množství jednotlivých látek ve všech částech soustavy již nemění.
Gibbsův zákon fází vyjadřuje vztah mezi veličinami charakterizujícími heterogenní soustavy.
f + v = s + 2
Termodynamická rozdělovací konstanta
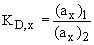
Koncentrační rozdělovací konstanta
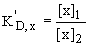
Rozdělovací poměr, distribuční koeficient
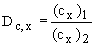
Separační faktor
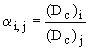
Výtěžek dělení
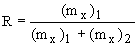
Procento extrakce
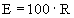
Obohacovací faktor
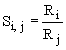
ROZDĚLENÍ SEPARAČNÍCH METOD PODLE DRUHU FÁZÍ
plyn ® plyn
tepelná difuze
plyn ® kapalina
chromatografie plyn - kapalina (GLC)
headspace metody
plyn ® tuhá látka
chromatografie plyn - tuhá látka (GSC)
kapalina ® plyn
destilace
kapalina ® kapalina
chromatografie kapalina - kapalina (LLC)
extrakce kapalina - kapalina (LLE)
dialýza
ultrafiltrace
kapalina ® tuhá látka
chromatografie kapalina - tuhá látka (LSC)
srážení (precipitace)
elektrodepozice
krystalizace
tuhá látka ® plyn
sublimace
tuhá látka ® kapalina
zónové tavení
loužení
ROZDĚLENÍ SEPARAČNÍCH METOD PODLE MECHANISMU SEPARAČNÍHO PROCESU
mechanický princip separace
podle velikosti
dialýza, filtrace a ultrafiltrace, GPC, GSC
podle hustoty
centrifugace a ultracentrifugace
fyzikální princip separace
rozdělování
GSC, GLC, LSC, LLC, LLE
změna stavu
destilace, sublimace, krystalizace
migrace
elektroforéza
chemický princip separace
změna stavu
srážení, elektrodepozice
iontová výměna
IEC
specifická vazba
afinitní chromatografie
DRUHY INTERAKCÍ
1. van der Waalsovy síly
a) disperzní síly (London)
indukovaný dipól - indukovaný dipól
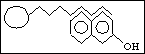
b) orientační síly (Keesom)
dipól - dipól
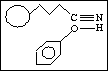
c) indukční síly (Debye)
dipól - indukovaný dipól
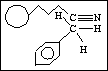
2. elektrostatické síly (Coulomb)
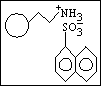
3. vodíková vazba
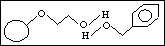
Podobné se rozpouští v podobném.
® Nepolární látky se lépe rozpouští v nepolárních rozpouštědlech a adsorbují na nepolárních površích.
® Polární látky se lépe rozpouští v polárních rozpouštědlech a adsorbují na polárních površích.
CHROMATOGRAM
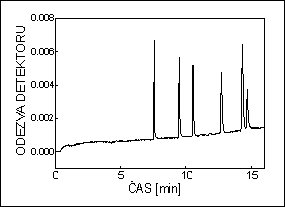
základní linie
šum
drift
pík (eluční křivka)
plocha píku, A
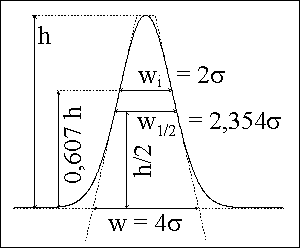
výška píku, h
šířka píku, w
pološířka píku, w1/2
retenční čas, tR
migrační čas, tmig
CHROMATOGRAFIE
je separační (dělící) a současně i analytická metoda
(tj. poskytuje kvalitativní a kvantitativní informace o vzorku).
využívá distribuce látek mezi dvě fáze:
- mobilní (pohyblivou)
- stacionární (nepohyblivou)
různá hlediska dělení chromatografie
1) povaha mobilní fáze : plynová (GC), kapalinová (LC)
2) způsob provedení : kolonová (sloupcová), plošná (planární)
3) princip separace : rozdělovací, adsorpční, iontově výměnná, gelová, afinitní
4) pracovní způsob : eluční (analytická ch.), frontální, vytěsňovací
5) účel : analytická, preparativní (preparační)
PŘEHLED CHROMATOGRAFICKÝCH TECHNIK
Mobilní fáze : plyn (plynová chromatografie) GC
Stacionární fáze
kapalina
plynová rozdělovací chromatografie GLC
tuhá látka
plynová adsorpční chromatografie GSC
Mobilní fáze : kapalina (kapalinová chromatografie) LC
Kolonová
Stacionární fáze
kapalina
kapalinová rozdělovací chromatografie LLC
gelová permeační chromatografie GPC
tuhá látka
kapalinová adsorpční chromatografie LSC
iontově výměnná chromatografie IEC
Planární
Stacionární fáze
kapalina
papírová rozdělovací chromatografie PC
tenkovrstvá rozdělovací chromatografie TLC
tuhá látka
tenkovrstvá adsorpční chromatografie TLC
soubory pdf: preSM1.pdf sepmet.pdf
[ Domovská stránka |
Separační metody |
HPLC |
GC |
CES |
CZE |
MECC |
CEC |
TLC a PC |
Extrakce, GPC, IEC a AC |
Otázky |
Cvičení |
Témata |
Kvalitativní analytická chemie |
Základní praktika |
Seminář z analytické chemie |
Analytické separační metody ]
8.1.1996 © Pavel Coufal